我院免疫学学科姚新生教授课题组利用单个B细胞受体测序(scBCR-seq)技术解析了双BCR B淋巴细胞的比例及可能重排机制,近日,该研究以“scBCR-seq revealed a special and novel IG H&L V(D)J allelic inclusion rearrangement and the high proportion dual BCR expressing B cells”为题发表于《Cellular and Molecular Life Sciences》杂志,(https://link.springer.com/article/10.1007/s00018-023-04973-8,中科院一区Top期刊,IF2023=8.0),研究生朱兰伟、彭芪和吴颖杰为共同第一作者,姚新生教授为通讯作者。本研究受国家自然科学基金(82160279)和贵州省高层次人才项目[No.(2018)5637]的资助。
B淋巴细胞由Max D.Cooper等1965年发现和命名(Nature. 1965 Jan 9:205:143-6),在适应性免疫应答中发挥着核心作用。B细胞在维持自身耐受的同时,能够介导机体对多种多样的抗原产生特异性的应答并保持免疫记忆,其机制源于“一个淋巴细胞只表达一种受体”的克隆选择学说(Burnet,1959)和胚系“V-D-J等位基因排斥重组”而形成的庞大的CDR3组库(Tonegawa S,1976,PNAS. 1976;73(10):3628-32)。然而,早在1961年,Makela等人发现从免疫大鼠淋巴结中分离的单个细胞能同时产生抗H抗体和抗O抗体(J Immunol. 1961 Oct;87:457-63);1985年,Feddersen等人证实单个浆细胞的两条κ链等位基因同时经历了重排(等位基因包容重组,PNAS. 1985 Jul;82(14):4793-7)。之后,双受体B淋巴细胞一直有着细胞水平和特殊动物模型实验证据的支撑,但基于研究技术的限制,从大规模的B细胞水平,分析双BCR B细胞的比例和来源机制尚未得到阐明。
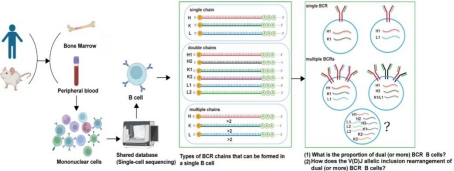
本研究利用单个B细胞受体测序(scBCR-seq)技术,能在大量的单个B细胞水平上,获取CDR3全长mRNA序列分析BCR配对的重链和轻链V(D)J家族组成优势,通过人和小鼠骨髓和外周血(GEO和10×Company共享)B细胞scBCR-seq组库,分析单个B细胞的功能性IGH(免疫球蛋白重链)和IGL(免疫球蛋白轻链)的配对。本研究观察到生理状态下,双BCR B细胞表现出稳定的高比例,人类骨髓和外周血中约含有10%的双(或多)BCR B细胞,而在小鼠外周血和骨髓的记忆B细胞中,这一比例达到了约20%,无论在人类还是小鼠的中枢和外周样本中,双BCR B细胞可表达五种类型的链(μ、γ、α、δ、ε),提示双BCR B细胞同样能进行类别转换(CSR)。在每个人类和小鼠的研究样本中,均存在单个B细胞中单条链三种(或更多)功能性重排,通过分析V(D)J基因家族的位置、方向等组成特征,提示单个B细胞中,存在单条染色体的两个(或更多)等位V(D)J的包含重排(mRNA分子水平证据),B细胞功能性V(D)J重组切除环有可能进行mRNA的转录表达,参与BCR的配对或调控蛋白的表达。本研究分析结果表明V(D)J等位基因排斥重排和等位基因包含重排机制和效应研究的复杂性和重要性,为研究双BCR B细胞的比例、来源和机制提供了全新的技术方法和建模等参考,从而首次建议开展“双BCR B细胞亚群”分类,研究其生理和病理的重要性,并强调在分析scBCR-seq组库数据时,需要对单配对BCR细胞、双(或多)BCR配对B细胞,以及无法组装成BCR的B细胞进行分类,分析其比例和功能,不能仅仅分析总的具有功能性IGH(或IGL)mRNA并将它们全部纳入生理或病理的相关解析中,这可能会导致BCR信息的扩大和失真。
(一审:覃明、二审:韩勇、三审:罗军敏, 图文:姚新生教授课题组)